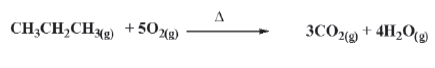(Suprema/2018-2)
A combustão do propano é representada pela seguinte equação química não balanceada:
Se houver consumo de 176 gramas de propano a cada 15 minutos de reação, o
número de mols de dióxido de carbono produzido em 1 hora será:
a) 16,0 mols de CO2
b) 36,0 mols de CO2
c) 48,0 mols de CO2
d) 12,0 mols de CO2
RESOLUÇÃO:
Pela equação fornecida (que está balanceada), percebe-se que a combustão de 1 mol de propano (CH3CH2CH3) origina 3 moles de CO2.
Massa molecular do propano: 44 g/mol
Então:
44g de propano ———— 1 mol de CO2
176 g de propano ———– x
x = 12 moles de CO2 (em 15 minutos de reação).
Em 1 hora (60 minutos = 4 intervalos de 15 minutos) , o total de moles de CO2 será 4 x 12 = 48 moles
Resp.: C
VEJA TAMBÉM:
– Questão resolvida sobre estequiometria, da UNIFAE