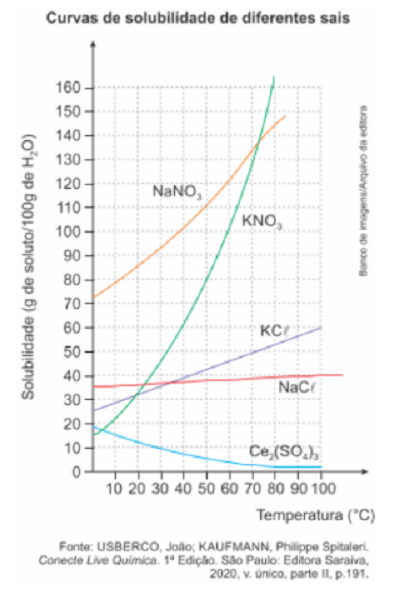
(EsPCEx – Aman/2022) Com base no gráfico a seguir, que representa as curvas de solubilidade de cinco substâncias em água, analise as afirmativas:
Dado: densidade da água a 10 °C e a 50 °C = 1,0 kg L-1 .
I – A dissolução do nitrato de sódio em água é um processo endotérmico.
II – Na temperatura de 20 °C, é possível solubilizar iguais quantidades de matéria, em mol, de nitrato de potássio e de cloreto de potássio em água.
III – Para preparar uma solução saturada de cloreto de potássio em 500,0 mL de água a 70 °C, seria necessário dissolver aproximadamente 250,0 g do sal no solvente.
IV – A dissolução de uma amostra de sulfato de cério III em uma quantidade adequada de água, de forma a se obter uma solução insaturada, forma uma mistura homogênea com maior temperatura de ebulição em relação à água pura.
V – Dissolvendo-se completamente 1 mol de cada um dos cinco sais mencionados no gráfico em cinco amostras de água de mesmo volume, de forma que cada amostra de água recebesse apenas um dos sais, obter-se-iam cinco soluções com igual pressão de vapor a uma mesma temperatura.
VI – Uma solução saturada de nitrato de potássio a 50 °C deve apresentar concentração de aproximadamente 8,0 mol L-1 .
Das afirmativas feitas, estão corretas apenas
A) I, II, III e VI.
B) I, II, IV e V.
C) I, III, IV e VI.
D) II, III, V e VI.
E) III, IV, V e VI.
RESOLUÇÃO:
Analisando cada item:
I) Verdadeiro. O aumento da temperatura favorece a solubilidade do NaNO3 em água, o que indica que o processo é favorecido com o fornecimento de calor (processo endotérmico).
II) Falsa. À temperatura de 20ºC tem-se a mesma solubilidade em g/100mL, não em mol/L.
III) Correta. À temperatura de 70ºC a solubilidade do KCl em água é de 50 g/100 mL.
Então:
100 mL ———- 50 g
500 mL ———– x ⇒ x = 250 g de KCl.
IV) Correta. A presença de um soluto em um solvente aumenta seu ponto de ebulição.
V) Falsa. A pressão de vapor depende da quantidade de íons em solução (quanto maior a quantidade de íons, menor a pressão de vapor).
No caso da questão, 1 mol de sulfato de cério, quando em solução, libera 5 moles de íons:
Ce2(SO4) 3 → 2 Ce3+ + 3 (SO4)2-
Os demais sais liberam uma menor quantidade de íons. Logo, as pressões de vapor não serão iguais.
VI) Correta. À temperatura de 50ºC, a solubilidade do KNO3 é de 100g/100 mL.
Massa molar do KNO3 = 101 g/mol (39 + 14 + 48)
Número de moles KNO3 em 100g de água = 80/101 ≅ 0,79 moles em 0,1L
Logo:
Molaridade = número de moles : volume (em litros)
M = 0,79 : 0,1 ⇒ M ≅ 7,9 moles/L
Resp.: C
VEJA TAMBÉM:
– Questão resolvida sobre solubilidade de compostos orgânicos, do Insper 2019
Organize seus Estudos


Caderno Espiral Melissa Pautado 17x24 Colmeia
Preço: R$ 34,11













