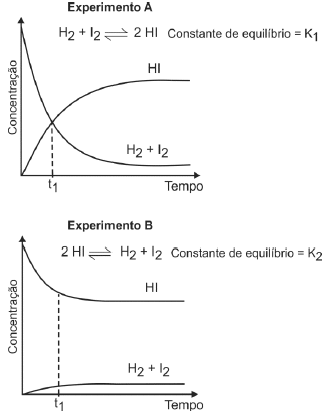
(Fuvest/2013) A uma determinada temperatura, as substâncias HI, H2 e I2 estão no estado gasoso. A essa temperatura, o equilíbrio entre as três substâncias foi estudado, em recipientes fechados, partindo-se de uma mistura equimolar de H2 e I2 (experimento A) ou somente de HI (experimento B).
A) no experimento A, ocorre diminuição da pressão total no interior do recipiente, até que o equilíbrio seja atingido.
B) no experimento B, as concentrações das substâncias (HI, H2 e I2) são iguais no instante t1.
C) no experimento A, a velocidade de formação de HI aumenta com o tempo.
D) no experimento B, a quantidade de matéria (em mols) de HI aumenta até que o equilíbrio seja atingido.
E) no experimento A, o valor da constante de equilíbrio (K1) é maior do que 1.
Resolução:
A) Falsa, pois, as quantidades de matéria são iguais no início e no fim.
B) Falsa. As concentrações das substâncias (HI, H2 e I2) são iguais no instante t1, somente no experimento A (leitura direta dos gráficos).
C) Falsa. A velocidade de formação de HI diminui com o tempo, pois, a quantidade de reagentes também diminui.
D) Falsa. A quantidade de matéria (em mols) de HI diminui com o tempo, até atingir o equilíbrio (leitura direta do gráfico).
E) O cálculo da costante de equilíbrio é dado por:
Resp.: E
Veja também:
– Questão comentada sobre energia de ativação, da F.M.Olinda 2016